Lo que KCRI está trabajando
Qué es un estudio clínico?
Cómo Funciona
Antes de comenzar un estudio clínico, la FDA que el medicamento o el dispositivo sea sometido a unas pruebas iniciales en animales para probar su sefuridad y eficacia antes de ser movidas a pruebas en humanos. Una vez las pruebas en humano comiencen, existen 4 etapas o fases de tratamiento. Los estudios de Fase I son estudios de determinación de dosis y son conducidos en pequeñas poblaciones. Los estudios en la Fase II se enfocan en la seguridad del paciente y trabajan para identificar los posibles efectos secundarios con los tratamientos. Los estudios de Fase III son estudios grandes que son conducidos a miles de pacientes. El enfoque principal de estos estudios es de recopilar más información en la efectividad de la droga y monitorear los componentes de seguridad adicionales antes de ser presentados ante la FDA para aprobación. La etapa final, Fase IV, observa a una población más diversa después de que la FDA apruebe el medicamento.
Los estudios clínicos son conducidos de acuerdo a un plan llamado protocolo. El protocolo provee continuidad para el estudio y describe cómo éste será conducido. Este le deja saber a los equipos de estudio que pruebas y procedimientos llevar a cabo en cada visita y le provee con información en cómo identificar los posibles efectos secundarios. El protocolo también le indica al equipo del estudio a cómo recolectar la data que se necesita para evaluar la terapia. El protocolo está escrito utilizando directrices establecidas por la FDA y la Junta de Revisión Institucional para mantener a los pacientes seguros.
Aunque cada estudios es diferente en cómo son conducidos, los procesos comoquiera tienen semejanzas.
- Consentimiento Informado
- Proceso de Selección (típicamente de 2-12 semanas)
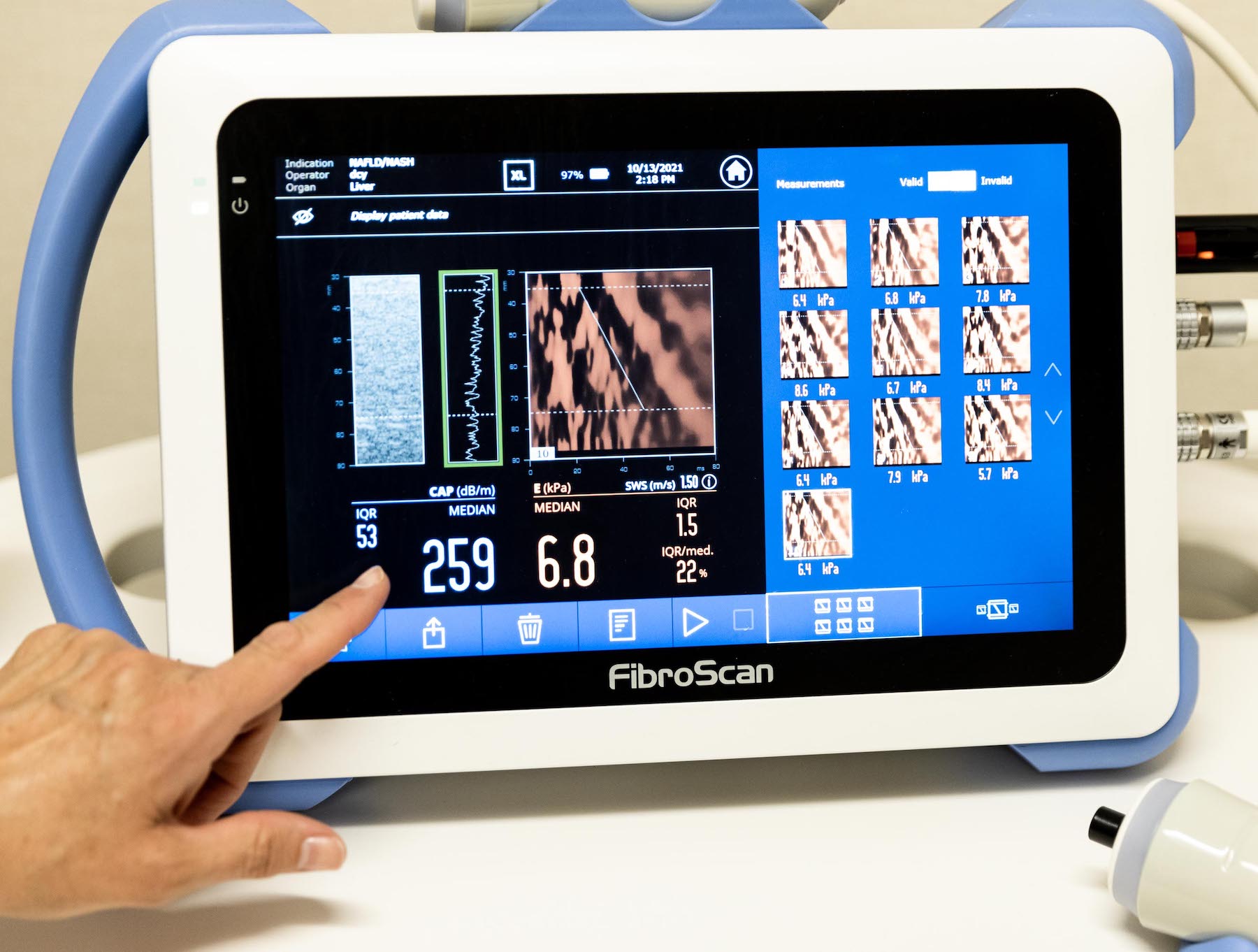
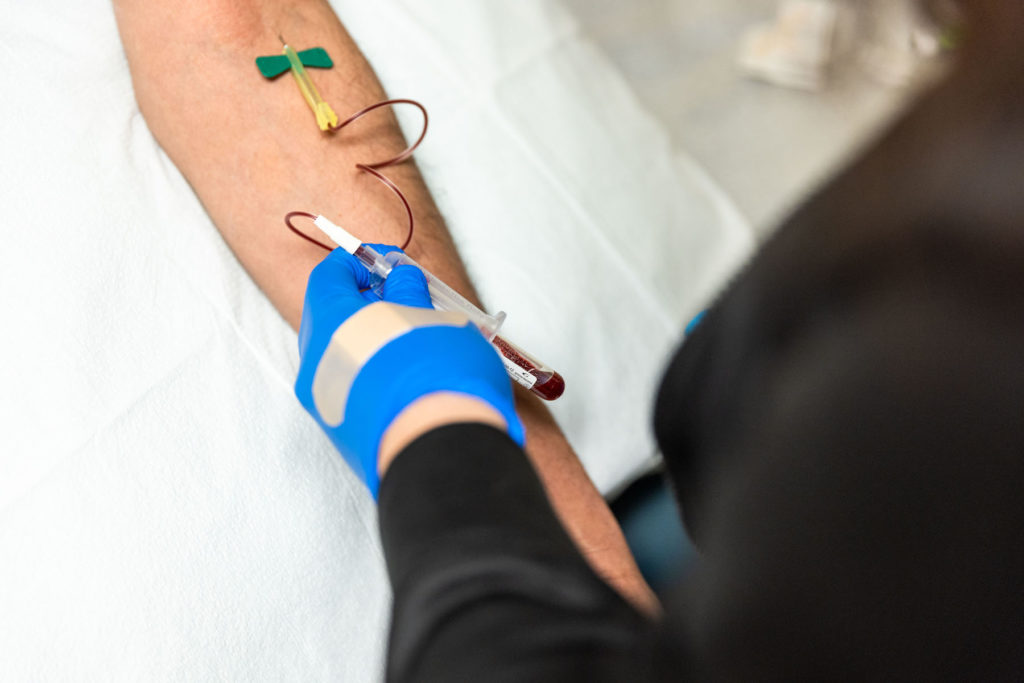
- Procedimientos de estudios (por ejemplo; imágenes, laboratorios, biopsia)
- Comienzo de terapia (aleatorización)
- Periodo de tratamiento (varía dependiendo de la etapa de estudio)
- Fin de tratamiento
- Seguimiento
Consentimiento Informado
Los voluntarios que participen en una investigación deben de estar de acuerdo a los términos establecidos en el protocolo del estudio. Ellos hacen esto al leer y firmar un documento llamado Consentimiento Informado. El Consentimiento Informado describe qué es lo que significa participar y el proceso que usted está aceptando al unirse al estudio. Los participantes pueden retirar el consentimiento del estudio en cualquier momento que decida que ya no quiere participar.
Kansas City Research Institute
Beneficios
Porqué se hacen estudios clínicos?
- Conocimiento Médico Avanzado
- Promueve tratamientos nuevos y prometedores
- Facilita acceso a medicamentos que de otro modo no se podrían obtener
- Produce data que apodera tanto a los profesionales médicos como a los pacientes a tomar decisiones informadas sobre el cuidado de la salud
Existen varias razones para conducir un estudio clínico incluyendo para determinar si una droga nueva es segura y efectiva.
Adicionalmente, estas investigaciones estudian maneras alternas para utilizar y mejorar tratamientos existentes. Ellas también desarrollan métodos seguros para la administración de tratamientos a poblaciones en las cuáles no han sido probadas anteriormente.